鋰電池開發(fā)史(五):鋰電池事故原因大多為過充電
2015-03-20 09:17:48 日經(jīng)BP 過充電是二次電池的大敵
什么才叫正確使用電池?最重要的是避免過充電。微量的過充電也有可能導致冒煙和著火等事故。比如說,F(xiàn)UJITSU TECHNO RESEARCH曾對4.25V和4.30V電壓下充電的LIB分別進行了“擠壓測試”和“穿釘測試”(圖1)。結果,4.25V充電的LIB沒有出現(xiàn)問題,而4.30V充電的LIB出現(xiàn)了冒煙和著火。區(qū)區(qū)50mV的差別,就有可能釀成重大事故。
 |
| 圖1:電池燃燒的一大原因在于過充電 充電電壓僅相差50mV左右,電池就會發(fā)生燃燒(a,b)。(攝影:FUJITSU TECHNO RESEARCH) (點擊放大) |
過充電導致事故的危險性不僅存在于LIB,還存在于所有二次電池。比如說安全性遠高于LIB的Ni-Cd(鎳鎘)二次電池。電解液使用水溶液,正極和負極分別使用鎳(Ni)和鎘(Cd)的化合物。沒有任何著火要素。盡管如此,這種電池依然會因過充電而處于危險狀態(tài)。
Ni-Cd二次電池充滿后,正極將產(chǎn)生氧氣,負極將產(chǎn)生氫氣。一旦混合形成氧氣與氫氣體積比為1:2“爆鳴氣”,在遇到某些誘因的時候,很容易發(fā)生爆炸。
為防止這種現(xiàn)象發(fā)生,Ni-Cd二次電池通過改良,在負極采用了超過必需量的鎘化合物。如此一來,在充電快要結束的時候,正極將先行充滿并產(chǎn)生氧氣,而負極還存在未充電的部分,將繼續(xù)充電。正極產(chǎn)生的氧氣移動到負極,與負極充電完成部分的金屬鎘發(fā)生反應。反應后的金屬鎘回到未充電狀態(tài)。這使得負極總是存在未充電的部分,能夠不斷消耗正極輸送來的氧氣。
這個方法看似萬無一失,其實也存在弱點。在低溫下,吸氧反應的反應速度慢,鎘負極的吸氧反應將受到抑制。氧氣發(fā)生與吸收的平衡一旦打破,負極將達到充滿狀態(tài)并產(chǎn)生氫氣,從而形成爆鳴氣。這種情況容易在快速充電等使用大電流充電時發(fā)生。
過充電為什么危險?
對于LIB,過充電造成的影響更嚴重。原因在于過充電會造成兩個大問題。一個是超過負極鋰容量(理論容量,石墨為372mAh/g)的鋰將轉化為金屬鋰,以枝晶狀析出。這有可能造成內部短路。
另一個是正極會產(chǎn)生反應性非常強的氧氣。如果氧氣與LIB內的電解液、鋰和碳的化合物結合,也就是發(fā)生氧化反應,可能會導致發(fā)熱和著火。
下面以正極的代表性物質鈷酸鋰(LiCoO2)為例,來詳細解釋一下其中的原因。LiCoO2的結構是在氧化鈷(CoO2)層之間插入鋰。充電時,鋰將脫離正極,向負極移動。鋰脫離后,“空房子”(空隙)將會增加。鈷(Co)會趁虛而入,鉆進這些“空房子”寄住。隨著充電的進行,“空房子”越多,或是溫度越高,鈷越容易發(fā)生移動。鈷移動到鋰曾經(jīng)的地盤后,之前與鈷組成CoO2的氧將失去伙伴,也從正極脫離。
這些氧是以原子狀態(tài)單獨存在的“初生態(tài)氧”,反應性非常強,與任何物質都很容易發(fā)生反應注1)。LIB中含有容易氧化的電解液、鋰和碳的化合物,這些物質會與氧結合,導致發(fā)熱和著火。
注1)空氣中的氧是原子結合形成的氧氣(02)(鍵位占滿),反應性不強。如果反應性強,生物在呼吸時,肺就會與氧氣發(fā)生反應并灼傷,無法生存。我們必須感謝氧氣不具備強反應性。
“初生態(tài)氧”會在怎樣的條件下產(chǎn)生?我們以Li1-xCoO2的x為參數(shù),通過利用熱質量分析法檢測改變溫度時的質量變化,對相關條件進行了研究(圖2)。結果顯示,x越大,也就是充電進度越大,質量開始減少的溫度越低,減少量越大。質量減少是氧脫附的表現(xiàn)。而且我們還發(fā)現(xiàn),充電進度越大(x越大),脫附的氧越多,氧脫附發(fā)生的溫度越低。也就是說,要想抑制“初生態(tài)氧”產(chǎn)生,不在超過規(guī)定的電壓下充電(避免過充電)、電池不升溫注2)是必需條件。為滿足這些條件,組裝企業(yè)等LIB的使用者必須小心謹慎。
注2)在合成LiCoO2時添加鋁(Al)和鎂(Mg)也是抑制初生態(tài)氧產(chǎn)生的有效手段。添加這些物質后,氧脫附溫度將升高,在一定程度上可以遏制脫附反應。
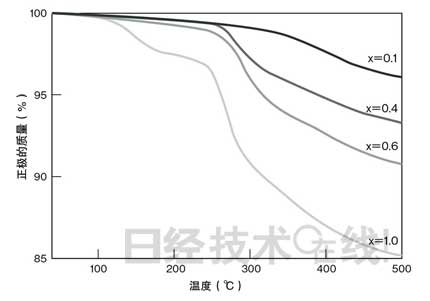 |
| 圖2:充電進度越大,正極質量越小 通過Li1-xCoO2的x的差異表示正極的質量變化。x越大表示充電進度越大。隨著氧脫附的進行,正極質量變小。 (點擊放大) |
快速充電是造成過充電的原因
容易發(fā)生過充電的情況主要有兩種:快速充電時、電池單元失衡時。先來看快速充電。
LIB推薦采用恒定電流/恒定電壓(CC/CV:constant current/constant voltage)充電。這是先在恒定電流下充電(CC充電),當達到規(guī)定電壓后,切換至恒定電壓充電(CV充電)的方法(圖3)。通常的LIB在開始充電時,充電電壓為4.2V,電流為1C注3)。因為電流為1C,所以在理論上,1個小時后,端電壓將達到4.2V。但充電電壓與端電壓之間,存在叫作“過壓”*的偏差。因此,當充電電壓達到4.2V時,實際的端電壓低于4.2V。
注3)以1C充電是指以理論上可1小時充滿的電流充電。電池容量為2000mAh時,1C為2000mA。5C充電則是以1C的5倍,也就是1萬mA的電流充電。
*過壓=電極反應產(chǎn)生電流時,電極電位會偏離平衡電位。這個偏移叫作過壓。比如說,在進行電解時,加載的電壓不高于理論電壓,就不會發(fā)生電解。對電池來說,實際的電池電壓低于由正極、電解液、負極的組合決定的理論電壓。
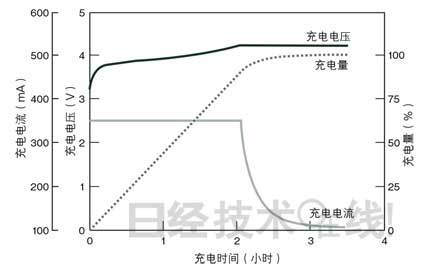 |
| 圖3:恒定電流/恒定電壓充電(CC/CV)的情況 LIB推薦采用以恒定電流開始充電,在達到規(guī)定電壓后,切換至恒定電壓充電的CC/CV充電。 (點擊放大) |
這就是說,充電電壓達到4.2V時,電池沒有充滿,充電量僅為70~80%左右。要想繼續(xù)充滿,需要切換到CV充電,在維持4.2V的充電電壓的同時,慢慢補充剩余的20~30%。不過,在CV充電時,電流會縮小,如果為縮短充電時間,擴大CC充電時的電流值,過壓的偏移將會增大,使充電電壓提前達到4.2V。電池可能會需要更長的時間才能充滿。
如果只需充入70~80%的電量,通過在CC充電時進行大電流快速充電,20~30分鐘即可完成。但是,要想利用CC充入接近100%的電量,則有些不切實際。因為達到這個目的需要的電壓高于4.2V的規(guī)定電壓,會形成“快速充電=過充電”的等式。
設置保護電路應對單元失衡
最近有一種思路:即使充電電壓超過規(guī)定電壓,只要采用脈沖充電的方式,借助電流的中斷,就不會造成過充電。但脈沖充電的暫停時間意味著脈沖電流要大于連續(xù)充電的電流。雖然充電快,但必須加載高于規(guī)定值的電壓,依然會造成過充電。大家千萬不要誤會。
造成過充電的另一個因素是電池組電池單元性能的失衡。下面以兩個單元串聯(lián)而成的簡單電池組為例進行介紹。
假設兩個單元中的一個劣化嚴重,容量出現(xiàn)失衡。如果在這種狀態(tài)下為兩個單元充電,容量劣化的單元將提前達到充滿狀態(tài)。假設一方的電壓為4.2V,另一方為3.8V。此時,充電電壓為4.2V的2倍,也就是8.4V,按照簡單推算,充電結束時,一個單元的電壓為4.4V,另一個為4.0V。4.4V的單元明顯處于過充電狀態(tài)。
避免失衡導致過充電的方法,是在外部設置保護電路,在單元電壓達到4.2V時停止充電。但是,如果單元數(shù)量多,采用這種方法需要設置大量的FET,用來監(jiān)控電壓,在成本上并不劃算。
對氧化還原對材料寄予期望
不依賴保護電路等裝置,使電池自身能夠防范過充電的材料一直沒有停下開發(fā)的腳步。雖然尚未投入實用,但作為此類材料的代表,氧化還原對材料的前景備受看好。材料的作用機制不難解釋,已經(jīng)得到了Ni-Cd二次電池和鎳氫二次電池的采用。
關于Ni-Cd二次電池的過充電問題,前面已經(jīng)說過,在充滿電時,正極將產(chǎn)生氧,產(chǎn)生的氧將被負極消耗。換句話來說,就是正極產(chǎn)生(氧化反應)的氧在負極消耗(還原反應),這個過程耗時漫長。在充電時,電池處于下面的循環(huán)狀態(tài)。
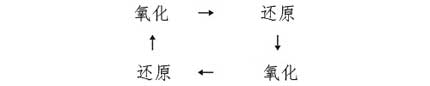 |
也就是說,只要形成這樣的循環(huán),就能制造出不會出現(xiàn)過充電的電池。這叫作氧化還原對反應。氧化還原(Redox)包括還原(Reduction)與氧化(Oxidation)兩個步驟。
LIB不能像Ni-Cd二次電池那樣,直接賦予其氧化還原對功能。這是因為在充電時如果不控制電壓,正極的Li+(鋰離子)將源源不斷地被運往負極。LIB發(fā)生氧化還原對反應必須另行采用具備該功能的材料。這已經(jīng)成為了電池開發(fā)人員長年面對的課題。
采用由具備氧化還原對功能的單元組成的電池組可以解決電池單元失衡的問題(圖4)。當某個特定單元提前充滿后,該單元的氧化還原對功能將啟動,停止為電極充電。而未充滿的其他單元的氧化還原對功能不啟動,繼續(xù)進行充電。
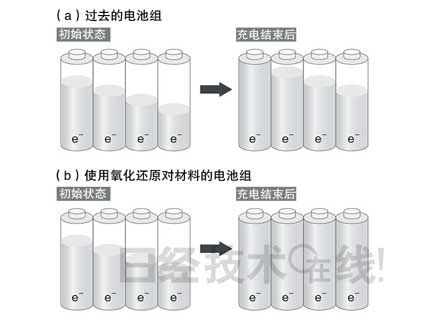 |
| 圖4:使用氧化還原對材料可以解決電壓的不均 過去的電池組在單元失衡的狀態(tài)下停止充電的情況(a),使用氧化還原對材料的電池組可以使所有單元達到相同電壓(b)。圖片根據(jù)3M公司的論文制作。 (點擊放大) |
筆者的研究室曾在大約25年前嘗試開發(fā)過氧化還原對材料。我們當時嘗試的材料只能在非常小的電流下產(chǎn)生氧化還原對反應,應付不了通常的充電電流。
近年來,隨著仿真技術的進步,人們對于什么結構的化合物會發(fā)生氧化還原對反應已經(jīng)有了一定的了解。2008年,美國3M公司開發(fā)出在3.9V的電壓下工作的氧化還原對材料,使實用化帶上了一絲現(xiàn)實色彩(圖5)。現(xiàn)在,在4.2V下工作的材料也在研究之中,如果有效,應該可以應用于占據(jù)LIB主流的LiCoO2系電池。
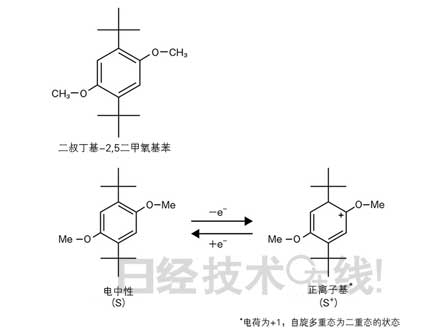 |
| 圖5:在3.9V下工作的3M公司的氧化還原對材料 通過反復進行氧化還原反應防止過充電的氧化還原對材料的研究是新一代電池開發(fā)的一大焦點。3M公司開發(fā)出了在3.9V下工作的材料。圖片根據(jù)3M公司的論文制作。 (點擊放大) |

EETOP 官方微信

創(chuàng)芯大講堂 在線教育

半導體創(chuàng)芯網(wǎng) 快訊
相關文章